與外源性凝血途徑不同,內(nèi)源性凝血途徑中參與凝血過程的凝血因子全部來自于血管內(nèi),為血液的單獨過程。內(nèi)源性凝血途徑中的凝血因子不僅能單獨引發(fā)內(nèi)源性凝血過程,而且是外源性凝血過程迅速擴增放大的必需因素。靜脈血栓的臨床發(fā)病率比較高,且主要是由內(nèi)源性凝血途徑造成的,因此選擇性內(nèi)源性凝血抑制劑可以為多種血栓性疾病提供更加安全有效的治療選擇,特別是心肌梗死、缺血性心臟病,以及如經(jīng)皮冠狀動脈介入治療、血液透析、血液分離、心臟瓣膜置換術等需要體外循環(huán)支持系統(tǒng)的抗凝治療。
]]>作用機制:
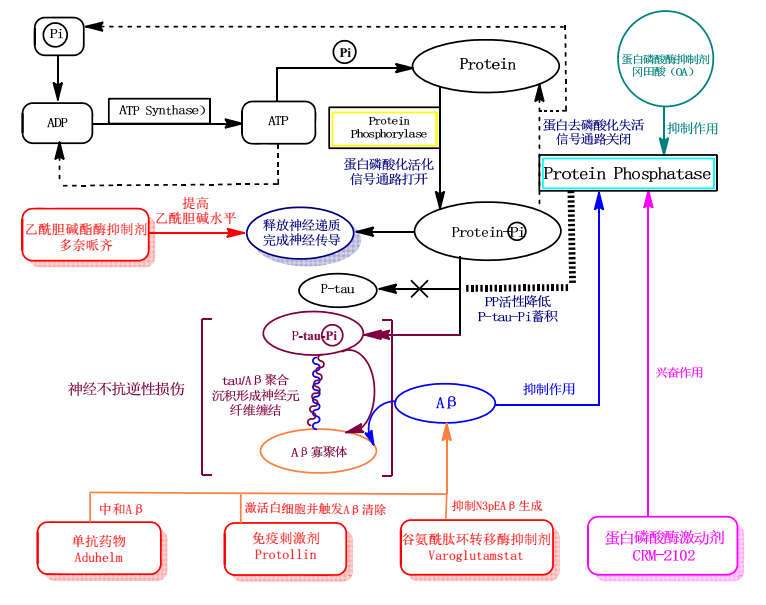
蛋白磷酸酶(PP2A)激動劑,提高PP2A生物活性,催化蛋白去磷酸化以維持正常的神經(jīng)活動;促進P-tau去磷酸化,避免因tau過度磷酸化所介導的神經(jīng)毒性和神經(jīng)細胞死亡。
阿爾茨海默病(AD)病理損傷示意圖
英文名稱:Teruravone
研究代號:TR
劑型:凍干粉針。
規(guī)格:15mg
注冊分類:化學藥1類
適 應 癥:用于改善急性缺血性腦梗塞所致的神經(jīng)癥狀、日常生活活動能力和功能障礙
專利等知識產(chǎn)權(quán)保護情況:ZL200910129816.3
臨床批件:2017L04386;2017L04387
研究進展: I期臨床研究
藥理作用及作用機制:本品是一種腦神經(jīng)保護劑,作用機制為清除氧自由基,抑制腦細胞的氧化損傷。臨床前研究提示,大鼠在腦缺血再灌注后靜脈給予本品,呈劑量依賴性改善缺血再灌注引起的神經(jīng)缺陷癥狀,減小腦梗死面積,抑制脂質(zhì)過氧化,改善感覺運動功能、空間學習記憶障礙和腦組織病理學損傷。
1、流行病學
急性腦卒中是臨床多發(fā)病,具有較高的致死率、 致殘率,居所有疾病致殘率首位,嚴重危害人類健康。腦卒中后遺癥為不同程度的肢體功能障礙和語言障礙,腦卒中后往往合并一些并發(fā)癥,如認知障礙、癲癇、抑郁等。因此,急性缺血性腦卒中嚴重影響患者的生活質(zhì)量,給社會和家庭帶來沉重負擔。
據(jù)衛(wèi)生部統(tǒng)計中心發(fā)布的人群監(jiān)測資料顯示,城市居民心腦血管病死亡率已上升至第一、二位,農(nóng)村地區(qū)在二十世紀90年代初,心腦血管病死亡列第三位,90年代后期升至第二位。我國城市腦卒中的發(fā)病率、死亡率和患病率分別為219/10萬、116/10萬和719/10萬;農(nóng)村地區(qū)分別為185/10萬、142/10萬和394/10萬。據(jù)此估算全國每年新發(fā)腦卒中約200萬人,每年死于腦血管病約150萬人,存活的患者數(shù)(包括已痊愈者)600~700萬,約四分之三不同程度地喪失勞動能力,其中重度致殘者約占40%。預計腦血管病在我國還會繼續(xù)上升,造成的危害也將日趨嚴重,有必要加大防治力度,以盡快降低卒中的發(fā)病率和死亡率。
腦卒中的發(fā)病類型分為出血性腦卒中和缺血性腦卒中(腦梗死)。出血性腦卒中分為腦出血和蛛網(wǎng)膜下隙出血;而缺血性腦卒中根據(jù)國際上TOAST分類,可分為心源性腦栓塞、動脈粥樣硬化性腦梗死、小血管閉塞(包括無癥狀腦梗死)、其他病因引發(fā)的腦梗死、病因不明的腦梗死等。[4]腦卒中各亞型的頻率分布各地區(qū)差異較小,以缺血性卒中為主,約占60%-80%,腦出血和蛛網(wǎng)膜下腔出血死亡率高于腦梗死。在我國動脈粥樣硬化性腦梗死在各型腦卒中中所占的比例最大,我國心源性腦栓塞占3%以下。
2、適應癥的治療現(xiàn)狀和常用藥物
腦卒中癥狀包括突然麻木或無力,特別是一側(cè)肢體麻木、無力;突然意識混亂或言語不清、理解力障礙;突然出現(xiàn)一眼或雙眼視力障礙;突然不能行走,頭暈,平衡或協(xié)調(diào)喪失;無原因的突然嚴重頭痛、嘔吐、昏迷等全腦癥狀。
急性腦缺血發(fā)生后的8~10分鐘之內(nèi),局部缺血組織中心區(qū)神經(jīng)元就開始發(fā)生不可逆性壞死,周邊形成半暗帶。隨時間的推延,壞死灶不斷向外蔓延擴大,半暗帶不斷縮小,若及時應用溶栓治療,迅速恢復血流的灌流,半暗帶組織則可以逆轉(zhuǎn)并恢復功能。此時應用溶栓治療可以恢復血液的灌流。[5]
另一項研究提示,腦梗死患者中40%病例出現(xiàn)血栓自溶現(xiàn)象,血栓自溶的平均時間為18小時,即血栓形成后的18小時開始自溶。自溶后的病理性再灌注形成,鈣離子超載,有過量NO、氧自由基生成,細胞內(nèi)水腫、酸中毒以及凋亡基因激活,黏附分子和細胞因子異常表達,白細胞也參與了缺血/再灌注損傷誘發(fā)的炎性反應過程,這一系列的級聯(lián)反應形成的瀑布效應加重了神經(jīng)細胞的損傷。[5]
氧自由基介導的自由基連鎖反應是急性腦梗死神經(jīng)損傷尤其是遲發(fā)神經(jīng)元損傷的重要原因。自由基的產(chǎn)生途徑包括:(1) 缺血后黃嘌呤氧化酶形成增加,在催化次黃嘌呤轉(zhuǎn)變?yōu)辄S嘌呤并進而轉(zhuǎn)變?yōu)槟蛩岬倪^程中釋放大量電子,并為分子氧所接受,產(chǎn)生超氧陰離子自由基,后者在鈣離子的參與下形成更為活躍的羥氧自由基;(2) 中性粒細胞激活產(chǎn)生大量自由基;(3) 線粒體損傷導致細胞色素氧化酶系統(tǒng)功能紊亂,產(chǎn)生氧自由基;(4) 兒茶酚胺的自身氧化可產(chǎn)生氧自由基。
Coppieters等利用正電子發(fā)射型計算機斷層顯像技術(PET)研究顯示,腦損傷后,腦代謝狀況不良現(xiàn)象可持續(xù)14天之久,也就是說,失去溶栓機會的腦梗死患者,其局部缺血組織將遭受持續(xù)7~14天的代謝障礙和再灌注損傷。然而,在這種損傷的同時,維持足夠的平均動脈壓可使組織充分灌流,改善微循環(huán)并盡快消除再灌注損傷的毒性作用。上述研究結(jié)果為臨床提供了卒中急性期神經(jīng)保護性治療14天的理論依據(jù)。
腦梗塞由于腦血供障礙,造成神經(jīng)細胞功能喪失而引起的一系列神經(jīng)系統(tǒng)功能障礙性疾病。對腦梗塞的治療,迅速復流再通是腦梗塞急性期治療成功的前提,而延長腦細胞耐受缺氧的時間和加強復流再通后復雜的病理生理過程中的生存能力,是治療成功的基本保證。由于缺血性腦卒中后的病理生理改變極為復雜,有多種因素參與,除了腦缺血、缺氧對腦細胞造成損害,更嚴重的損害來自于再灌注損傷,病灶區(qū)在恢復血流過程中,鈣離子超載,大量NO和氧自由基以及脂質(zhì)過氧化物的產(chǎn)生,細胞膜受損,級聯(lián)反應形成的瀑布效應導致腦水腫、神經(jīng)細胞死亡、梗塞面積增大以及神經(jīng)癥狀的產(chǎn)生。
因此對腦缺血不能單純強調(diào)血液再灌流,而必須盡早應用抗自由基藥物,減輕腦梗死的缺血損傷,改善神經(jīng)功能,故選擇高效低毒藥物及聯(lián)合用藥治療是今后的發(fā)展方向。
根據(jù)中國急性缺血性腦卒中診治指南2010,目前已有多種可供選擇的急性缺血性腦卒中治療方法,對缺血性損傷病理生理機制中特定環(huán)節(jié)進行干預,近年研究熱點為改善腦血循環(huán)的多種措施,溶栓治療 (如尿激酶、r-tPA等)、抗血小板聚集 (如阿司匹林等)、抗凝治療(如肝素等)、降纖、以及神經(jīng)保護等多種藥物。因此在有效治療時間內(nèi)應聯(lián)合應用不同作用機制的藥物,其中最主要的是與腦神經(jīng)保護藥物的聯(lián)合。
溶栓治療是目前最重要的恢復血流措施,重組組織纖溶酶原激活劑(r-TPA)和尿激酶(UK)是我國目前使用的主要溶栓藥物,有效搶救半暗帶的時間窗為4.5~6小時,并增加顱內(nèi)出血風險;腦卒中后48h內(nèi)口服抗血小板聚集藥阿司匹林能顯著降低病死或殘疾率,減少復發(fā),僅輕度增加顱內(nèi)出血風險;由于腦梗死急性期血漿纖維蛋白酶原和血液黏滯度增高,蛇毒酶制劑可顯著降低血漿纖維蛋白酶原,并可輕度溶栓,抑制血栓形成,因此對不適合溶栓并經(jīng)嚴格篩選的腦梗死患者,特別是高纖維蛋白血癥者,可選擇降纖治療,主要降纖藥物有降纖酶(Defibrase)、安克洛酶(Ancrod)等。
3、同類藥物的特點
中國急性缺血性腦卒中診治指南2010認為,針對急性缺血或再灌注后細胞損傷的神經(jīng)保護藥物可保護腦細胞,提高對缺血和缺氧的耐受性。其中依達拉奉為作為一種自由基清除劑能改善急性腦梗死的功能結(jié)局并安全,推薦意見是I級推薦,B級證據(jù)。[8]
依達拉奉(Edaravone,MCI-186),化學名3-甲基-1-苯基-吡唑啉-5-酮,是一種合成的氧自由基清除劑,于2001年在日本首次上市用于治療急性腦梗塞。本品能抑制黃嘌呤氧化酶和次黃嘌呤氧化酶的活性,刺激前列環(huán)素的生成,減少炎癥介質(zhì)白細胞三烯生成,降低羥自由基濃度,縮小缺血半暗帶發(fā)展成梗死的體積,并抑制遲發(fā)性神經(jīng)元死亡。[9][10]
在日本最新腦卒中治療指南2004年“腦卒中治療指導原則”中,依達拉奉作為唯一經(jīng)大規(guī)模臨床試驗證實有效,并根據(jù)循證醫(yī)學的證據(jù)被推薦用于急性腦梗塞的腦神經(jīng)保護劑,為腦卒中的治療提供一種有效治療手段。
??? 依達拉奉作為氧自由基清除劑,還用于肌肉萎縮性側(cè)索硬化癥(Amyotrophic lateral sclerosis,ALS)治療,原研廠家田邊三菱制藥公司正進行該適應癥的III期臨床試驗。
4、本品的特點、開發(fā)依據(jù)和臨床意義
急性腦卒中是臨床多發(fā)病,具有較高的發(fā)病率、致死率和致殘率,在有效治療時間內(nèi)應聯(lián)合應用不同作用機制的藥物,對缺血性損傷病理和生理機制中特定環(huán)節(jié)及時進行干預,改善急性腦梗死的功能結(jié)局,降低致死率和致殘率。目前急性腦卒中治療一項重要措施就是盡早應用腦神經(jīng)保護藥物,減輕腦梗死的缺血損傷,改善神經(jīng)功能。目前依達拉奉作為唯一經(jīng)大規(guī)模臨床試驗證實有效,并根據(jù)循證醫(yī)學的證據(jù)被推薦用于急性腦梗塞的腦神經(jīng)保護劑。由于依達拉奉消除氧自由基能力較弱,臨床上有效的腦神經(jīng)保護劑品種極為有限。因此,有必要研究開發(fā)安全、高效的新型腦神經(jīng)保護劑滿足臨床治療的需要,為醫(yī)生和患者臨床治療提供更多的選擇。
基于先導化合物依達拉奉結(jié)構(gòu),分別對依達拉奉的苯環(huán)和吡唑環(huán)進行了結(jié)構(gòu)改造和構(gòu)效關系研究,并通過分子骨架遷越(scaffold hopping)藥物設計方法,設計、合成系列具有噁嗪環(huán)結(jié)構(gòu)的全新化合物,經(jīng)體內(nèi)外藥效篩選發(fā)現(xiàn)了新衍生物泰瑞拉奉,具有顯著清除羥氧和超氧自由基作用,體內(nèi)多個藥效模型也表明泰瑞拉奉能顯著改善缺血腦損傷引起的神經(jīng)缺陷癥狀,減小腦梗死面積,藥效明顯優(yōu)于依達拉奉,具備進一步開發(fā)的價值。旨在研究開發(fā)具有消除氧自由基作用更強、安全性良好,具有較好臨床應用特點的腦神經(jīng)保護藥,臨床用于改善急性腦梗塞所致的神經(jīng)癥狀、日常生活活動能力和功能障礙。
4.1、藥學特點
泰瑞拉奉合成方法簡單,工藝穩(wěn)定,成本低廉,關鍵中間體質(zhì)量標準控制嚴格,質(zhì)量可控,三廢少且易處理,適宜工業(yè)化生產(chǎn);本品呈結(jié)晶態(tài),晶型穩(wěn)定,不含結(jié)晶水和結(jié)晶溶劑;影響因素試驗、加速試驗6個月及長期試驗36個月考察結(jié)果顯示本品穩(wěn)定性良好。
注射用泰瑞拉奉助溶劑為精氨酸,賦形劑為甘露醇。本品影響因素試驗、加速試驗6個月和長期穩(wěn)定性36個月試驗考察結(jié)果表明本品穩(wěn)定性良好。
4.2、藥理作用和作用機理特點
泰瑞拉奉作為腦神經(jīng)保護藥依達拉奉結(jié)構(gòu)類似物,作用機理一致,為氧自由基清除劑。大鼠體內(nèi)腦缺血模型證實,本品單次或者連續(xù)給藥14天,起效劑量為1.5 mg/kg,能顯著改善腦缺血引起的神經(jīng)缺陷癥狀,減小腦梗死面積,降低死亡率,顯著改善感覺運動功能、空間學習記憶障礙和腦組織病理學損傷。本品和依達拉奉量效關系試驗表明,本品1.5、3.0、6.0和12.0 mg/kg劑量組腦梗塞面積抑制率分別為34.6%、44.9%、58.9%和62.5%,依達拉奉同樣劑量抑制率分別為26.1%、35.6%、45.1%和42.1%,本品藥效強度明顯優(yōu)于依達拉奉。結(jié)合依達拉奉文獻報導,對于MCAO腦缺血再灌注模型,依達拉奉6 mg/kg已達藥效平臺劑量,其對應的臨床劑量(60 mg/日)也同樣達到到療效平臺劑量(依達拉奉II期臨床試驗,每次10mg、30mg和45mg,每天兩次,連續(xù)14天,三個劑量的臨床改善率分別為47%、67%和68%),其動物藥效與臨床療效有良好的一致性。而本品12 mg/kg才接近藥效平臺劑量,因此本品具有提高臨床療效的空間。
遠期藥效學試驗采用MCAO方法制備腦缺血再灌注模型,連續(xù)用藥14天,試驗結(jié)果表明泰瑞拉奉高劑量組(6.0 mg/kg)和中劑量組(3.0 mg/kg)體重增長與陽性對照藥依達拉奉(6.0 mg/kg)比較有統(tǒng)計學差異;泰瑞拉奉高、中劑量組動物死亡率分別為28.6%和47.1%,低于模型組,依達拉奉組死亡率為52.5%;泰瑞拉奉高、中劑量組改善腦缺血損傷導致的神經(jīng)缺陷癥狀,高劑量組改善空間記憶障礙,與依達拉奉組比較有顯著性差異。從各測定指標綜合看,泰瑞拉奉顯示出明顯的量效關系,優(yōu)于陽性對照藥依達拉奉。
體內(nèi)多個藥效試驗模型結(jié)果表明,本品保護腦缺血損傷具有明確的量效關系,可改善缺血腦損傷引起的神經(jīng)缺陷癥狀,減小腦梗死面積,在同等劑量下,本品藥效顯著優(yōu)于對照藥依達拉奉。預期通過臨床有效性研究,在安全劑量范圍內(nèi),具有探索提高臨床療效的可行性,從而更好地改善腦梗死患者的功能結(jié)局,降低致殘率和死亡率。
本品大鼠單次靜脈注射,藥效學起效劑量1.5 mg/kg在給藥30 min時的血漿濃度為15.2 μM,劑量3.0、6.0和12.0 mg/kg在給藥1 h時的血漿濃度分別為10.6、17.7和28.8 μM。推測本品臨床靜脈給藥可維持有效的血漿濃度。PK/PD試驗良好的相關性支持藥效隨血漿濃度增加而增強。
4.3、藥代動力學特點
臨床前藥代動力學研究表明,單次靜注泰瑞拉奉體內(nèi)藥代動力學特征呈線性,多次給藥體內(nèi)沒有蓄積。本品靜脈注射后可廣泛分布于組織包括腦組織。本品血漿蛋白結(jié)合率高,在大鼠體內(nèi)主要通過代謝消除,對主要CYP450酶無抑制和誘導作用,主要通過尿液排泄(78%),其次為膽汁排泄(22%)。
4.4、安全性特點
臨床前安全性評價結(jié)果表明,本品大鼠28天重復給藥試驗NOAEL劑量為45 mg/kg,毒性劑量為90 mg/kg,毒性表現(xiàn)僅為給藥第四周時雄性動物攝食量減少,恢復期可逆。 Beagle犬靜脈注射28天重復給藥試驗 NOAEL劑量為15 mg/kg,中毒劑量為45 mg/kg。毒性反應部位為消化系統(tǒng)、神經(jīng)系統(tǒng)和唾液內(nèi)分泌系統(tǒng),毒性作用均為功能性,且作用可逆。臨床使用時應注意藥物對消化系統(tǒng)、神經(jīng)系統(tǒng)和唾液內(nèi)分泌系統(tǒng)可能存在的不良反應。因此本品大鼠和犬28天重復給藥的安全范圍良好,毒性作用均為功能性且可逆。本品無潛在遺傳毒性,不影響大鼠的生育力,對胎鼠無致畸作用。安全藥理學試驗未見對中樞神經(jīng)系統(tǒng)作用,對心血管系統(tǒng)包括Q-T間期和呼吸系統(tǒng)沒有影響。犬28天重復給藥心電圖未見Q-T間期改變。特殊安全性試驗被動皮膚過敏和全身主動過敏為陰性,對紅細胞無溶血和凝聚現(xiàn)象,無血管和肌肉刺激性。臨床前安全性評價結(jié)果提示本品安全窗較寬,臨床風險可控,支持進行I期臨床試驗。
大鼠起效劑量1.5 mg/kg,大鼠安全劑量45mg/kg。大鼠28天的NOAEL劑量安全范圍為藥效學最低有效劑量的30倍;按照AUC比,正常大鼠為36.4倍,MCAO大鼠為32.7倍。比格犬28天的安全劑量為15mg/kg,比格犬28天的NOAEL劑量安全范圍為藥效學最低有效劑量的30倍;按照AUC比為37.6倍。
5、綜合分析
急性腦卒中是臨床多發(fā)病,具有較高的致死率、 致殘率,居所有疾病致殘率首位,嚴重危害人類健康。氧自由基介導的自由基連鎖反應,是急性腦梗死神經(jīng)損傷尤其是遲發(fā)神經(jīng)元損傷的重要原因。因此盡早應用抗自由基藥物,減輕腦梗死的缺血損傷,改善神經(jīng)功能,故選擇高效低毒藥物及聯(lián)合用藥治療是急性腦卒中治療的重要策略。依達拉奉作為唯一經(jīng)大規(guī)模臨床試驗證實有效,并根據(jù)循證醫(yī)學的證據(jù)被推薦用于急性腦梗塞的腦神經(jīng)保護劑,為腦卒中的治療提供一種有效治療手段。但是依達拉奉療效較弱,臨床上有效的腦神經(jīng)保護劑品種極為有限,有必要研究開發(fā)安全、高效的新型腦神經(jīng)保護劑滿足臨床治療的需要。泰瑞拉奉作為依達拉奉的結(jié)構(gòu)類似物,作用機理一致,具有消除氧自由基作用更強、安全性良好,具有較好臨床應用特點的腦神經(jīng)保護藥,臨床可用于改善急性腦梗塞所致的神經(jīng)癥狀、日常生活活動能力和功能障礙。
大鼠起效劑量1.5 mg/kg,大鼠安全劑量45mg/kg。大鼠28天的NOAEL劑量安全范圍為藥效學最低有效劑量的30倍;按照AUC比,正常大鼠為36.4倍,MCAO大鼠為32.7倍。比格犬28天的安全劑量為15mg/kg,比格犬28天的NOAEL劑量安全范圍為藥效學最低有效劑量的30倍;按照AUC比為37.6倍。按照最小比30倍計算,人體等效劑量(HED)的最大安全劑量(MRSD)為7.29mg/kg。取安全系數(shù)10,人體首劑最大安全推薦起始劑量(MRSD)確定為0.729 mg/kg,按成人體重60kg計確定為43.7mg/日/人。具有較高的安全系數(shù)。這為本品提供臨床療效的安全空間。預期通本品臨床有效性研究(II、III期臨床研究),在安全劑量范圍內(nèi),探索本品達到更高的臨床改善率,從而更好地改善腦梗死患者的功能結(jié)局,降低致殘率和死亡率。臨床風險可控,支持進行I期臨床試驗。
?綜合泰瑞拉奉藥理毒理試驗資料,泰瑞拉奉作用機理明確,對腦梗塞對神經(jīng)細胞的損傷有顯著保護作用,有提高缺血性腦卒中臨床改善率的空間,具有較好的劑量安全性范圍,從而更好地改善腦梗死患者的功能結(jié)局。
]]>